Научные статьи
Производство и международные нормы масла чайного дерева
Научные исследования масла чайного дерева
Journal of Applied Microbiology 2000, 88. стр .170-175
Механизм антимикробного действия эфирного масла Melaleuca alternifolia (масло чайного дерева)
S.D. Cox 1 , C.M. Mann 1 , J.L. Markham 1 , H.C. Bell 2 , J.E. Gustafson 3 , J.R. Warmington 3 and S.G. Wyllie 3 .
1 Центр биоструктурных и биомолекулярных исследований. Университет Западного Сиднея, Хоксбери, Новый Южный Уэльс,
2 Австралийский научно-исследовательский институт масла чайного дерева. Лисмор. Новый Южный Уэльс,
3 GeneticaBiotechnologies, Бентли, Западная Австралия
7236/5/99: получено 14 мая 1999 года; доработано 16 августа 1999 года и принято 16 августа 1999
S.D. COX, CM, MANN, J.L. MARKHAM, H.C. BELL, J.E. GUSTAFSON, J.R. WARMINGTON AND S.G. WYLLIE. 2000. Эфирное масло Melaleucaalternifolia(чайное дерево) обладает широким спектром антимикробной активности. Механизм его действия в отношении грамотрицательных бактерий EscherichiacoliAG100, грамположительных бактерий StaphylucoccusaureusNCTC8325, а также дрожжевых грибков Candida Albicans исследовался с помощью нескольких методов. В данной статье сообщается, что воздействие на эти микроорганизмы масла чайного дерева в минимальной ингибирующей и минимальной бактерицидной/фунгицидной концентрации вызывает угнетение дыхания, а также увеличение проницаемости цитоплазматической мембраны бактерий и плазматической мембраны дрожжей, подтверждаемое поглощением йодидапропидия. У кишечной палочки и золотистого стафилококка масло чайного дерева также вызывало потерю ионов калия. Также наблюдались различия восприимчивости тестируемых организмов к маслу чайного дерева: они интерпретируются с точки зрения изменения скорости проникновения монотерпенов через клеточную стенку и структуры клеточной мембраны. Способность масла чайного дерева нарушать проницаемость барьера структур клеточных мембран с сопутствующей утратой хемиосмотического контроля является наиболее вероятной причиной его бактерицидного/ фунгицидного действия при минимальных ингибирующих уровнях.
ВВЕДЕНИЕ
Эфирное масло Melaleucaalternifolia, известное как масло чайного дерева, имеет долгую историю применения в качестве местного антисептика (Markham1999). В последнее время оно пользуется репутацией безопасного, естественного и эффективного антисептика. Это вызвало всплеск популярности этого масла и в настоящее время оно в качестве основного антимикробного вещества или естественного консерванта входит в состав многих фармацевтических и косметических продуктов наружного применения.
Химический состав масла чайного дерева хорошо изучен; оно содержит в основном циклические монотерпены (Brophyи др., 1989), из которых около 50% окисленных и около 50% углеводороды. Масло чайного дерева обладает широким спектром антимикробной активности (см. Markham1999 г. для обзора), которая в основном обусловлена терпинен-4-олом (Southwellи др. 1993; Carsonи Riley, 1995).
Как известно, множества разных эфирных масел обладают антимикробными свойствами и во многих случаях эта способность связана с наличием активных монотерпеновых компонентов (Knoblochи др. 1988; Beylier1979; Morrisи др. 1979). Некоторые исследования также показали, что монотерпены оказывают мембраноразрушающий эффект (обзор Sikkemaи др., 1995). Изучение клеток кишечной палочки после контакта с маслом чайного дерева с помощью электронной микроскопии показало потерю клеточного электроноплотного материала и коагуляцию цитоплазматических компонентов, хотя было очевидно, что эти эффекты вторичны и произошли уже после гибели клеток (Gustafsonи др. 1998). Это масло также стимулирует выведение ионов калия из клетки, а также угнетало дыхание во взвесях клеток кишечной палочки, что подтверждает его летальное действие путем цитоплазматического повреждения мембраны (Cox и др., 1998).
Ниже сообщаются результаты дальнейшего изучения антимикробной активности масла чайного дерева в отношении трех клинически важных микроорганизмов Е. coli, Staphylоcoccusaureusи Candida Albicans.
МАТЕРИАЛЫ И МЕТОДЫ
Масло чайного дерева
Во всех тестах применялось масло чайного дерева из партия 6081, предоставленное MainCamp, Ballina, Новый Южный Уэльс, Австралия.
Рост тестовых микроорганизмов
Использованные во всех анализах клетки два раза пересевались в ISO-сенситест бульон (Oxoid, Basingstoke, Великобритания) при исследовании кишечной палочки штамма AG100, дериват К-12 (Geоrgeи Levi, 1983) или Staph. aureusNCTC8325, и в бульон с экстрактом солода (Oxoid) при опытах с C. AlbicansKEMН5 при 37 ° C.
Минимальные ингибирующие концентрации (МИК) и минимальные бактерицидные / фунгицидные концентрации (МБК).
Определение МИК/МБК выполнялось согласно описанию проводили, как описано у Gustafson и др. (1998), со следующими исключениями. В экспериментах с C. Albicansвместо бульона с экстрактом солода (Oxoid) использовался ISO-сенситест бульон (Oxoid), из разведенной/анализируемой смесибыл исключенТвин-80. Минимальная бактерицидная/фунгицидная концентрация определялись путем отбора проб по 100 мкл из каждой пробирки, в которых отсутствовал рост на нейтрализующем бульоне, содержащем 30 г/л триптон-соевого бульона (Oxoid), 30 г/л нейтрализованного гидролизата печени (Oxoid) и 10 г/л лецитина (DefianceMillingCo., AcaciaRidge,, Квинсленд). После 10 мин инкубации при комнатной температуре в каждую пробирку добавлялось по 10 мл ISO-сенситест (или бульон с экстрактом солода в опытах с C. Albicans), и затем выполнялась инкубация при 37 ° С в течение 72 часов. Минимальная бактерицидная/фунгицидная концентрация определялась как минимальная концентрация масла чайного дерева, при которой отсутствовал рост микрофлоры.
Анализ жизнеспособности
Ночная культура инокулировалась на ISO-сенситест бульон (бульона с экстрактом солода, используемый в экспериментах с C. Albicans). Культура выращивалась при 37 °С до экспоненциальной фазы (4-5 ч), один раз промывалась и ресуспендировалась в стерильные 100-мл конические колбы, содержащие по 20 мл суспензии клеток и заданный объем масла чайного дерева. Содержимое каждой колбы постоянно перемешивалось магнитной мешалкой для равномерного распределения масла по всему объему. Через заданные промежутки времени отбирались аликвоты (1 мл) в 9 мл нейтрализующего бульона и выдерживались при комнатной температуре 10 минут. Выполнялись 10-кратные последовательные разведения нейтрализующего бульона в 0,1% пептона, которые разливались в подготовленные чашкис триптон-соевым агаром (Oxoid). Колонии подсчитывались после 3-х дневной инкубации при 37 ° Cи количество жизнеспособных клеток сообщалось как число колониеобразующих единиц (КОЕ) на мл.
Измерение дыхания
Уровень микробного дыхания определялся с помощью кислородного электрода, согласно описанию Cox и др. (1998). В экспериментах с Е. coliи C. Albicansклеточные суспензии предварительно инкубировались в течение 5 минут при заданной концентрации масла чайного дерева, и затем измерялась дыхательная активность. В опытах с Staph. aureus, клетки в течение 10 минут предварительно инкубировались в присутствии масла чайного дерева, и затем выполнялись измерения.
Отток ионов калия
Концентрация ионов калия в суспензиях клеток измерялась с помощью калиевого селективного электрода согласно описанию Cox и др. (1998). Общая концентрация свободного калия в суспензии Staph. aureusопределялась после инкубации в лизостафине (100 мкг/мл) при 37° С в течение 60 минут с последующей обработкой ультразвуком. Для измерения суммарного свободного калия в C. Albicans, клетки лизировались инкубацией в хитиназе (lмг/мл) и литиказе (lмг/мл) при 37° С в течение 60 минут, а затем обрабатывались ультразвуком. Полнота лизиса в каждом случае подтверждалась микроскопическим исследованием.
Поглощение йодида пропидия
Клетки (100 мл культуры) выращивались в течение ночи согласно описанию выше, промывались и ресуспендировались в 50 ммоль/л натрий-фосфатном буфере, рН 7,1. Аликвоты (1 мл) помещались в конические колбы, содержащие 19 мл буфера и заданное количество масла чайного дерева. Плотность инокуляции составляла примерно 10 8 КОЕ/мл. После 30-минутной инкубации при комнатной температуре, аликвоты по 50 мкл переносились в пробирки Эппендорфа, содержащие 950 мкл фосфатного буфера в пробирках FACS(BectonDickinson, ImmunocytometrySystems, MountainView, Калифорния). Эти пробирки хранились на льду, и в них добавлялось по 5 мкл окрашивающего раствора, состоящего из 2-5 мг/мл йодида пропидия (MolecularProbes, Eugene, штат Орегон), растворенного в очищенной воде milliQ, до достижения конечной концентрации йодида пропидия 10 мкг/мл. Сразу же после этого определялась процентная доля клеток, окрашенных йодидом пропидия, с помощью FAC-Scanпроточного цитометра (BectonDickinson).
Анализ выведения карбоксифлуоресцеина под влиянием масла чайного дерева
По процедуре New(1990) готовились многослойные липидные везикулы. Фосфолипиды (14 мг фосфатидилэтаноламина, 4 мг фосфатидилглицерина и 2 мг кардиолипина) растворяли в хлороформе в круглодонной колбе на 100 мл и выпаривали досуха. После этого сухую смесь фосфолипидов ресуспендировали в 2 мл 50 ммоль/л натрий-фосфатного буфера, рН 7,0, содержащего самогасящуюся концентрацию карбоксифлуоресцеин (100 ммоль/л), с легким встряхиванием со стеклянными шариками. Полученную суспензию липосом (многослойных липидных везикул) затем диализовали на протяжении ночи для удаления неинкапсулированного карбоксифлуоресцеина. Суспензию липосом (100 мкл) вливали в пробирку Эппендорфа, и затем добавляли фосфатный буфер и заданное количество масла чайного дерева до достижения конечного объема 1 мл. После этого смесь перемешивали вихревой мешалкой и инкубировали на протяжении заданного интервала времени с периодическим перемешиванием каждые 5 минут. По окончанию инкубационного периода 50 мкл липосомной суспензии отбирали в 2 мл фосфатного буфера. Флуоресценцию измеряли в стеклянной кювете флуоресцентным спектрофотометром (HitachiF-4500, Hitachi, Сан-Хосе, Калифорния, США, λ ех = 470 нм;. λ е m = 520 нм). Стопроцентная утечка карбоксифлуоресцеина определялась путем добавления тритона X-100 1,0об.%.
РЕЗУЛЬТАТЫ
Минимальные ингибирующие концентрации (МИК) и минимальные бактерицидные/фунгицидные концентрации (МБК) масла чайного дерева
Для кишечной палочки штамма AG100 и Staph. aureusNCTC8325 значения МИК и MБК масла чайного дерева составляли соответственно 0,25об.% и 0,5об.%. Значения МИК и MБК для C. AlbicansKEM115 были в два раза ниже – соответственно, 0,125об.% и 0,25об.%.
Влияние масла чайного дерева на жизнеспособность клеток
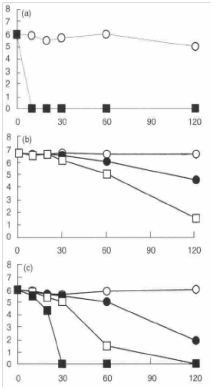
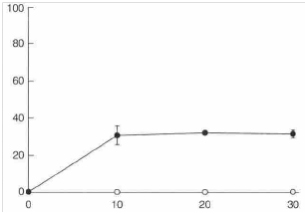
Влияние масла чайного дерева на жизнеспособность кишечной палочки, золотистого стафилококка и С. Albicansпоказано на рис. 1 (а, б, в). Каждый график отображает результаты трех отдельных экспериментов, показавших сходные результаты. К минимальной ингибирующей и минимальной бактерицидной концентрации масла чайного дерева наиболее чувствительной оказалась кишечная палочка, затем С. Albicansи, наконец, золотистый стафилококк.
|
Log 10 КОЕ/мл Log 10 КОЕ/мл Log 10 КОЕ/мл |
|
|
Время, минуты |
Рис. 1. Влияние масла чайного дерева на жизнеспособность тестовых микроорганизмов:
(а) кишечная палочка AG 100: (О) без масла чайного дерева; (■) 0,50 об.% масла чайного дерева.
(b) золотистый стафилококк NCTC 100: (О) без масла чайного дерева; (•) 0,25% об% масла чайного дерева; (■) 0,50 об.% масла чайного дерева.
(с) C. Albicans KEM Н6:100: (О) без масла чайного дерева; (●) 0,125 об.% масла чайного дерева; (□) 0,25 об.% масла чайного дерева; (■) 0,50 об.% масла чайного дерева.
Влияние масла чайного дерева на дыхание
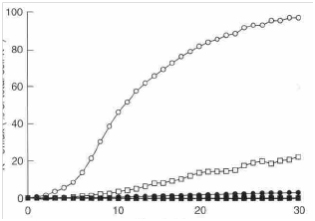
Масло чайного дерева угнетало дыхание в суспензии клеток кишечной палочки, золотистого стафилококка и C. Albicans(рис. 2). Угнетение дыхания Е. coliначиналось при 0,25 об.% масла чайного дерева и дыхание полностью останавливалось при 0,5об.%. Дыхание клеток С. Albicansугнеталось при 0,125об.%, которая являлась минимальной анализируемой концентрацией, соответствующей MИК этого микроорганизма. Ингибирование клеточного дыхания Staph. aureus(после 10 минут воздействия масла чайного дерева), начиналось при концентрации 0,5об.%.
Влияние масла чайного дерева на целостность мембраны
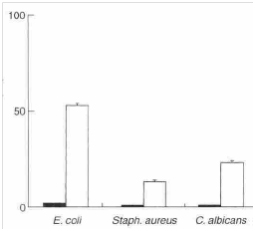
После 30-минутной экспозиции 0,25 об.% масла чайного дерева клеточных суспензий кишечной палочки, золотистого стафилококка и C. Albicansимело место увеличение клеточной проницаемости для йодида пропидия и флуоресцентно-окрашенной нуклеиновой кислоты (рис. 3), по сравнению с контрольной взвесью без масла чайного дерева. Отсутствие проникновения йодида пропидия через интактную цитоплазматическую или плазматическую мембрану (см. Brulи др. 1997; Masonи др. 1997; Wenischи др. 1997; Lebaronи др.1998) подтверждалась низким уровнем поглощения, наблюдавшимся в клетках, не подвергавшихся воздействию масла чайного дерева (рис. 3).
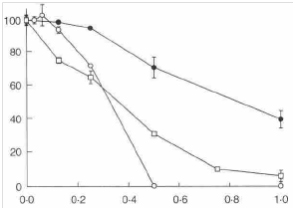
Масло чайного дерева в концентрации 0,25 об.% вызывало выведение ионов калия из клеток кишечной палочки и золотистого стафилококка (рис. 4). Данные трех отдельных, показавших сходные результаты, экспериментов свидетельствуют, что утечка из клеток E.coli начиналась сразу же после добавления масла чайного дерева и примерно через 30 мин достигала 100% суммарного запаса клеточного калия. Выведение ионов калия из клеток золотистого стафилококка начиналось примерно через 5 минут воздействия масла чайного дерева и продолжалось более медленными темпами, достигая после 30 мин 20%. Утечка ионов калия из клеток C. Albicans в присутствии 0,25об.% масла чайного дерева в течение двух часов не превышала фонового уровня (данные не представлены). Тем не менее, после 60-минутного контакта с 2,5 об.% масла чайного дерева количество калия в надосадочных жидкостях клеток составляло 23,1% от такового в надосадочных жидкостях общих клеточных лизатов.
Масло чайного дерева (0,25 об.%) также стимулировало выведение инкапсулированного карбоксифлуоресцеина из суспензии многослойных липидных везикул (рис. 5).
|
Угнетение дыхания, % от контроля |
|
|
Масло чайного дерева, об.% |
Рис. 2 Воздействие концентрации масла чайного дерева на скорость потребления О 2 в суспензии клеток кишечной палочки AG 100 (O), золотистого стафилококка NCTC 8325 (●) и C. Albicans KEM Н5 (□). Величина ошибки представлена стандартными отклонениями (n = 3) по данным двух экспериментов. В некоторых случаях величина погрешности была столь малой, что отображающий ее столбик перекрывался символом данных.
|
Процентная доля клеток, окрашенных йодидом пропидия |
|
Рис. 3 Поглощение йодида пропидия в суспензии клеток кишечной палочки AG100, золотистого стафилококка NCTC 8325 и C. Albicans KEM H5. Клетки подвергались воздействию 0,25об.% масла чайного дерева в течение 30 мин (□) и сравнивались с контрольной колбой без масла чайного дерева (■). Величина ошибки представлена стандартными отклонениями, рассчитанными по данным отдельных анализов (n = 3).
ОБСУЖДЕНИЕ
В этом исследовании масло чайного дерева в минимальной ингибирующей концентрации угнетало дыхание клеток кишечной палочки, золотистого стафилококка и C. Albicans. Не исключено, что масло чайного дерева напрямую ингибирует дыхательные ферменты или обменные процессы. Вместе с тем, полученные результаты показывают, что минимальные ингибирующие уровни масла чайного дерева также изменяют структуру клеточной мембраны. Наблюдалось повышенное поглощение нуклеиновой кислоты, окрашенной йодидом пропидия, для которого клеточные мембраны, как правило, непроницаемы. Кроме того, происходила утечка ионов калия, которая в суспензии клеток E.coli начиналась сразу же после добавления масла чайного дерева, а в суспензии клеток золотистого стафилококка в течение 5 минут.
|
Отток К+ (% от общих запасов К+ в клетках) |
|
|
Время, минуты |
Рис. 4 Действие 0,25 об.% масла чайного дерева на отток ионов калия в клеточных суспензиях кишечной палочки AG 100 и золотистого стафилококка NCTC 8325. (O): Е. coli 0,50% об% масла чайного дерева, (●):Е. coli, без масла чайного дерева. (□): Staph. aureus, 0,25% об% масла чайного дерева, (■):Staph. aureus без масла чайного дерева.
В экспериментах с C. Albicans не было обнаружено появления ионов калия в надосадочной жидкости клеток, содержащих 0,25 об.% масла чайного дерева. Тем не менее, окрашивание клеток С. Albicans йодидом пропидия после добавления масла чайного дерева является явным признаком повреждения плазматической мембраны. Возможно, что ионы калия не появляются в надосадочной жидкости (после воздействия на протяжении до 2 ч) потому, что они по-прежнему остаются заключенными в толстом слое клеточной стенки Candida Albicans. Учитывая повышенную проницаемость для йодида пропидия, представляется маловероятным, чтобы плазматическая мембрана оставалась непроницаемой для ионов калия. Дополнительным подтверждением общей токсичности масла чайного дерева в отношении мембранных структур является его влияние на проницаемость многослойных липосом.
Ранее мы показали, что масло чайного дерева в минимальной ингибирующей концентрации угнетает дыхание и вызывает утечку клеточного калия в клетках E.coli (Cox и др., 1998). Эти явления, а также выводы, представленные здесь, показывают, что масло чайного дерева повреждает структуру клеточных мембран кишечной палочки, золотистого стафилококка и C. Albicans. Цитоплазматические мембраны бактерий, плазматическая и митохондриальная мембраны дрожжей обеспечивают барьер для малых ионов, в частности H + , K + , Na + и Ca 2+ и позволяют клеткам и органеллам контролировать поступление и отток из клеток различных соединений. Эта роль барьера проницаемости клеточных мембран является неотъемлемой частью многих клеточных функций, в частности сохранение энергетического состояния клетки, других мембраносвязанных процессов энергообмена, транспорта солей, регуляции обмена веществ и регулирования давления тургора (Booth 1985; Poolman и др. 1987; Trumpower и Gennis 1994).
|
Отток карбоксифлуоресцеина, % от общего количества |
|
|
Время, минуты |
Рис. 5 Утечка карбоксифлуоресцеина из многослойных липидных везикул под влиянием масла чайного дерева. (О): без масла чайного дерева; (●): 0,25об.% масла чайного дерева. Величина ошибки представлена стандартными отклонениями (n = 2).
Антимикробное действие эфирных масел и их монотерпеноидных компонентов обычно объясняют токсическим действием на мембранные структуры и функции (Andrews и др. 1980; Uribe и др. 1985; Knobloch и др. 1988). Sikkema и др. (1994) показали, что циклические монотерпены за счет присущих им липофильных характеристик частично переходят из водной фазы в мембранные структуры. В результате происходит расширение мембран, увеличение проницаемости мембран и ингибирование мембранных ферментов. В клетках дрожжей и изолированных митохондриях, α- и β-пинены повреждают целостность клеток, угнетают дыхание и тормозят процессы переноса ионов, а также повышают проницаемость мембран (Andrews и др. 1980; Uribe и др. 1985). Недавно, Helander и др. (1998) описали влияние различных эфирных компонентов на проницаемость внешней мембраны грам-отрицательных бактерий. Тот факт, что вызванное маслом чайного дерева повреждение клеточной структуры мембран сопровождалось снижением жизнеспособности всех трех исследуемых микроорганизмов, заставляет предположить описанное Helander явление, как наиболее вероятную причину гибели клеток.
Несмотря на сходные значения МИК/МБК, исследуемые здесь микроорганизмы продемонстрировали явные отличия восприимчивости к маслу чайного дерева. Темпы снижения жизнеспособности С. Albicans в 0,25об.% масла чайного дерева были меньше, чем у кишечной палочки при воздействии той же концентрации; скорость инактивации золотистого стафилококка была медленнее, чем у кишечной палочки или C. Albicans. Относительное подавление дыхания и степень повреждения мембран этих микроорганизмов демонстрировали аналогичные тенденции. Учитывая широкий спектр антимикробной активности масла чайного дерева и общий мембрано-повреждающий эффект, вполне вероятно, что наблюдаемые отличия отражают скорость проникновения активных компонентов масла через клеточную стенку и в фосфолипидные участки клеточных мембранных структур.
Подведем итог: наши наблюдения подтвердили, что антимикробная активность масла чайного дерева объясняется его способностью нарушать проницаемость барьера мембранных структур микроорганизмов. Этот механизм действия одинаков в отношении клеток кишечной палочки, золотистого стафилококка и C. Albicans, и сходен с другими мембрано-активными дезинфицирующими средствами и консервантами широкого спектра действия, например, производными фенола, хлоргексидина (см. McDonnell и Russell 1999) и парабензойной кислоты (Sox 1997).
БЛАГОДАРНОСТЬ
Эта работа полностью профинансирована исследовательским институтом масла австралийского чайного дерева (ATTORI), Лисмор, Новый Южный Уэльс, Австралия.
СПИСОК ЛИТЕРАТУРЫ
Andrews, R.E., Parks, L.W. and Spcnce, K.D. (1980) Some effects of Douglas fir tcrpenes on certain microorganisms. Applied and Environmental Microbiology 40, 301-30A
Beylier, M. (1979) Bacteriostatic activity of some Australian essential oils. Perfumer and Fhivimrtst 4, 23-25.
Booth, LR. (1985) Regulation of cytoplasmic pH in bacteria Microbiological Reviews 49, 359-378.
Brophy, J.J., Davies, N.W., Southwell, LA., Stiff, LA. and Williams, L.R. (198**) Gas chromatographic quality control for oil of Melaleuca tcrpincn-4-ul type (Australian tea tret) Journal of Agricultural ami Food Chemistry 37, 1330- 1335.
Brul, S., Nusshaum, J. and Dielbandhoesing, S.K. (1997) Fluorescent probes for wall porosity and membrane integrity in filamentous fungi. Journal of Microbiological Methods 28, 169 178.
Carson, C.F. and Riley, T.V. (1995) Antimicrobial activity of the major components of the essential oil of Melaleuca alternifolia. Journal of Applied Btict-eriahgy 78, 264-269.
Cox, S.D., Gusrufson, J.K., Mann, CM., Markham, J.I,., Liew, Y.C., Ilarlland, R.P., Bell, H.C., Warmingtun, J.R. and Wyllie, S.G. (1998) Tea tree oil causes K4 leakage and inhibits respiration in Escherichia coli. Letters in Applied Microbiology 26, 355- 358.
George, A.M. and Levy, S.B. (1983) Amplifiablc resistance to tetracycline, chloramphenicol, and other antibiotics in Escherichia coli: involvement of a non-plasm id-determined efflux of tetracycline, Journal af Bacteriology 155, 531-540.
Gustafson, J.E., Liew, Y.C., Chew, S., Markham, J.L., Bell, H.C., Wyllie, S.G. and Warmington, J.R. (1998) Effects of tea iree oil on Escherichia colt. Letters in Applied Microbiology 26, 194—198.
Helander, I.M., Alakomi, H.-L., Kyosti, 1..-K., Mattila-Sandhulm, T., Pol, I., Smid, K.J., Gorris, G.M. and von VVrighi, A. (1998) Characterization of the action of selected essential oil components on Gram-negative bacteria. Journal of Agricultural Food Chemistry 46, 3590-3595.
Knobloch, K., Pauli, A,, Iberl, B., Wets, N. and Weigand, H. (1988) Antibacterial activity and antifungal properties of essential oil components. Journal of Essential Oils Research 1, 119-128.
Lebaron, P., Catala, P. and Parthuisot, N. (1998) Effectiveness of SYTOX Green stain for bacterial viability assessment. Applied and Environmental Microbiology 64, 2697-2700.
Markham, J. I.. (1999) Biological activity of tea tree oil. In Tea Tree, the Genus Melaleuca, ed. Southwell, I. and Lowe, R., pp. 169-190. Amsterdam: Harwood Academic Publishers.
Mason, D.J.. Dybowski, R., Earriek, J.W. and Gant, V.A. (1997) Antimicrobial action of rabbit leukocyte CAI'181(1(, n7. Antimicrobial Agents and Chemotherapy 41, 624-629
McDonnell, G. and Russell, A.D. (1999) Antiseptics and disinfectants: activity, action and resistance. Clinical Microbiology Reviews 12, 147-179.
Morris, J.A., Khettry, A. and Scitz, E.W. (1979) Antimicrobial activity of aroma chemicals and essential oils. Journal of the American Chemical Society 56, 595-603.
New, R.R.C. (1990) Characterization of liposomes. In Liposomes; A Practical Approach, cd. New, R.C.C., pp. 105-162. Oxford: IRI. Press.
Poolman, B., Driessen, A.J.M. and Konings, W.N. (1987) Regulation of solute transport in Streptococci by external and internal pH values. Microbiological Reviews 51, 498-508.
Sikkema, J., de Bunt, J. A.M. and Poolman, B. (1994) Interactions of cyclic hydrocarbons with biological membranes. Journal of Biological Chemistry 269, 8022 8028.
Sikkema, J., de Bunt, J.A.M. and Poolman, B. (1995) Mechanisms of membrane toxicity of hydrocarbons. Microbiological Reviews 59, 201-222.
Southwell, I.A., Hayes, A.J., Markham, J.I., and Leach, D.N. (1993) The search for optimally bioactive Australian tea tree oil. Acta Horheulturac 334, 265-275.
Sox, T.E. (1997) Mechanisms ofacrion of cosmetic preservatives. In Cosmetic Microbiology: a Practical Handbook-, ed. Brannan, D.K. pp. 163 176, Boca Raton, FL: CRC Press.
Trumpower, B.E. and Gennis, R.B. (1994) Energy transduction by cytochrome complexes in mitochondrial and bacterial respiration: the enzymology of coupling electron transfer reactions to transmembrane proton translocation. Inmial Reviews in Biochemistry 63, 675-716.
Uribe, S., Ramirez, T. and Pena, A. (1985) Effects of/f-pinene on yeast membrane functions. Journal of Bacteriology 161, 1195-1200.
Wenisch, C, Linnau, K.F., Parschalk, B., Zedtwitz-Lebenstein, K. and Georgopotous, A. (1997) Rapid susceptibility testing of fungi by flow cytometry using vital staining. Journal of Clinical Microbiology 35, 5-10.
Влияние происхождения сырья на безопасность и эффективность масла чайного дерева (Melaleuca alternifolia)
C. F. Carson 1 иT.V. Riley 1,2
1 Отделение микробиологии медицинского центра им. королевы Елизаветы II университета Западной Австралии, Недландс, WA 6009, Астралия
2 Отделение микробиологии и инфекционных болезней Западно-австралийского центра патологии и медицинских исследований, Локед-Бэг 2009, Недландс, WA 6009, Австралия
Обсуждаются идентичность, источники сырья и состав масла чайного дерева (Melaleuca alternifolia), а также указаны ошибки, встречающиеся в ранних литературных источниках. Приведен обзор отчетов о терапевтических и аллергических эффектах.
Ключевые слова : масло чайного дерева, Melaleuca alternifolia; масло мелалеуки, химический состав, контактная аллергия, антимикробные, медикаменты. © Munksgaard, 2001.
Принято к публикации 29 января 2001
В последней публикации этого журнала (1) после сообщения о небольшом количестве отчетов о контактном дерматите в связи с эвкалиптолом описан случай контактного дерматита, вызванного эвкалиптолом, полученного из Malaleuca alternifolia (2). На основании этого может сложиться впечатление, что весь эвкалиптол экстрагируют из Melaleuca alternifolia . Вместе с тем, эвкалиптол, известный как 1,8-цинеол, является основным компонентом эвкалиптового масла, получаемого отжимом из различных видов эвкалипта, в частности Eucalyptus globulus и E. polybractea, а M. alternifolia – это основное сырье для промышленного изготовления эфирного масла, называемого маслом чайного дерева. Хотя оба рода Eucalyptus и Melaleuca принадлежат к семейству Myrtaceae , состав получаемых из них масел кардинально отличается.
Описывающая 4 случая аллергии на масло чайного дерева статья Van der Valk с соавторами (2) внесла еще больше путаницы относительно эвкалиптола и масла чайного дерева. Упоминаемое в этой статье масло чайного дерева, полученное якобы из M. alternifolia , почему-то описывается как содержащее эвкалиптол. В обеих этих статьях и в еще одно раннем отчете об одном случае аллергии в качестве основных компонентов масла чайного дерева указаны a-пинен, b-пинен, п-цимен, эвкалиптол, линалоол, терпинеол и b-кариофиллен. Если в этих работах исследовалось масло такого состава, то оно не имело ничего общего с маслом чайного дерева, выделяемого из M. Alternifolia, и не соответствует требованиям международного стандарта по составу масла чайного дерева (4).
Эти несоответствия обуславливают определенную путаницу относительно идентичности, источников сырья и состава масла чайного дерева. Приведем и другие, недавно появившиеся в литературе заблуждения, в частности, что масло чайного дерева должно содержать не менее 30% терпинена (5), что M. alternifolia произрастает в Испании, Португалии, Калифорнии и островах Океании (3, 6), что «каепутовое масло» - это синоним масла чайного дерева (7), о существовании перекрестной сенсибилизации или перекрестной реакция на колофоний (6, 8, 9), а также что основным аллергеном является эвкалиптол (2).
Вместе с тем, начиная с 1996 года состав масла чайного дерева регламентируется международным стандартом масла чайного дерева "Oil of Melaleuca - terpinen-4-oltype (tea tree oil)'' [масло мелалеуки , терпинен-4-ол типа (масло чайного дерева)] (4). В основу этого стандарта был положен стандарт Австралии (10) и, заметим, нигде в этих стандартах не сказано, из каких видов растений должно производиться это масло. Стандарт Австралии регламентировал содержание в составе масла чайного дерева 1,8-цинеола не более 15% и терпинен-4-ола не менее 30%. Заменивший этот документ международный стандарт является более полным, и устанавливает требования по граничному содержанию 14 из примерно 100 компонентов (таблица 1). Международный стандарт регламентирует содержание терпинен-4-ола в масле более 30% (4), хотя на практике содержание этого соединения в масле редко когда ниже 40%.
Таблица 1. Требования к составу масла чайного дерева a)
|
Компонент |
Минимум, % |
Максимум, % |
|
терпинолен |
1.5 |
5 |
|
1,8-цинеол |
- |
15 |
|
a-терпинен |
5 |
13 |
|
g-терпинен |
10 |
28 |
|
п-цимен |
0.5 |
12 |
|
терпинен-4-ол |
30 |
- |
|
a-терпинеол |
1.5 |
8 |
|
Лимонен |
0.5 |
4 |
|
Сабинен |
Следовые к-ва |
3.5 |
|
Аромадендрен |
Следовые к-ва |
7 |
|
d-кадинен |
Следовые к-ва |
8 |
|
Глобулол |
Следовые к-ва |
3 |
|
Виридифлорол |
Следовые к-ва |
1.5 |
|
a-пинен |
1 |
6 |
a) По материалам источника (4).
Масло чайного дерева производят главным образом из M. alternifolia , выращиваемого на промышленных плантациях в штатах Новый Южный Уэльс и Квинсленд в Австралии. До начала промышленного выращивания природный ареал M. alternifolia ограничивался местностью вокруг рек Кларенс и Ричмонд на северо-восточном побережье Нового Южного Уэльса. Соответствующее международному стандарту масло можно получать и из других видов Melaleuca, в частности из M. dissitiflora и M. linariifolia (12). Кроме того, не исключено существование и других видов, из которых можно получать соответствующее стандарту масло.
В некоторых случаях установить ботаническое происхождение эфирного масла затрудняет широкое распространение общеупотребительных названий, которые не позволяют точно определить происхождение растительного сырья. Так, используется ряд исторических названий масла чайного дерева, в частности «масло мелалеуки» и «чайное масло». Широко применяемое в Маори и Самоа название «чайное масло» относится к маслу из растений рода Cordyline (13). Использование же термина «масло мелалеуки» вообще вводит в заблуждение, поскольку в некоторых случаях подразумевается масло абсолютно иного химического состава, получаемого из других видов Melaleuca , например, каепутовое масло (также «каепут» или «каюпут») из растений M. Cajuputi, или масло найоли из M. quinquenervia (которое часто путают с M. viridiflora ) (14). На данный момент Австралийская администрация лекарственных средств в качестве официального названия утвердила термин «масло мелалеуки».
Еще больше этот вопрос усложняет использование общеупотребительных названий растений. В Австралии «чайное дерево», также известное как «бумажнокорое дерево», является обобщающим названием нескольких сот видов растений рода Melaleuca и Leptospermum . Например, M. cajuputi часто называют «болотное чайное дерево» и «чайное дерево с бумажной корой», а M. quinquenervia – «широколиственное чайное дерево» или «широколистное бумажнокорое дерево» (14). Окультурено множество видов Leptospermum , и многие из них часто ошибочно считаются сырьем получения масла чайного дерева. Также следует отметить, что т.н. новозеландское масло чайного дерева, получаемое из произрастающих в Новой Зеландии растений Kunzea ericoides и Leptospermum scoparium (называемое еще эфирным маслом, соответственно кануки или мануки), не имеет ничего общего с собственно маслом чайного дерева, поскольку имеет абсолютно другой состав (15).
В литературе опубликован ряд отчетов о положительных кожных аллергических пробах на масло чайного дерева (2, 3, 6-8, 16, 17). Однако сообщенный в двух отчетах состав исследуемого масла (2, 3) не соответствовал требованиям международного стандарта или действовавшего ранее австралийского стандарта. В другом отчете (7) трудно идентифицировать исследуемое масло, поскольку часто в качестве синонима использовался термин «каепут», а данные о составе не приведены. Также под большим вопросом предположение о перекрестной сенсибилизации масла чайного дерева и колофония. Так, в исходном отчете описания случая (6) вообще не было указаний на перекрестную реакцию или перекрестную сенсибилизацию масла чайного дерева и колофония. Там только отмечалось совпадение положительных кожных аллергических проб на оба вещества. Но причинная связь между этими двумя веществами не доказана (17).
Предпринимались определенные попытки по обнаружению компонентов масла чайного дерева, которые, могли бы отвечать за аллергические реакции. Среди таких компонентов назывались 1,8- цинеол, (3), D- лимонен, a-терпинен, аромадендрен, терпинен-4-ол, a-фелландрен, п-цимен, a-пинен, терпинолен (18) и a-терпинен (19). В других работах (20, 21) в качестве наиболее вероятных аллергенов назывались продукты окисления. Поскольку окисленное масло чайного дерева является более сильным аллергеном, чем свежее масло, частоту нежелательных реакций можно свести к минимуму не допуская применения старого окисленного масла. Также проводилась работа по определению степени этих эффектов, приемлемых параметров стабильности, соответствующей технологии производства готовой продукции и процедур хранения.
Данные in vitro исследований показывают, что масло чайного дерева ( M. alternifolia ) является потенциально полезным местным антимикробным средством (22-24), и последние клинические испытания показали многообещающие результаты (25, 26). Вместе с тем, необходимы дополнительные данные о in vivo эффективности и безопасности масла чайного дерева. Однако для объективной оценки биологических свойств масла чайного дерева, включая и его аллергенности, в литературе должна сообщаться точная информация как о самом масле, так и о его свойствах.
Список литературы
1. Vilaplana J, Romaguera C. Allergic contact dermatitis due to eucalyptol in an anti-inflammatory cream. Contact Dermatitis 2000: 43: 118.
2. Vander Valk PGM, De GrootAC, Bruynzeel D P, Coenraads P J, Weijland J W. Allergic contact dermatitis from 'tea tree' oil. Ned Tijdschr Geneeskd 1994: 138: 823-825.
3. De Groot A C, Weyland J W. Systemic contact dermatitis from tea tree oil. Contact Dermatitis 1992: 27: 279-280.
4. International Organisation for Standardisation. Essential oils - oil of Melaleuca, терпинен-4-ол type (tea tree oil). ISO-4730. Geneva: International Organisation for Standardisation, 1996.
5. Treudler R, Richter G, Geier J, Schnuch A, Orfanos C E, Tebbe B. Increase in sensitization to oil of terpentine: recent data from multicenter study on 45,005 patients from the German-Austrian Information Network of Departments of Dermatology (IVDK). Contact Dermatitis 2000: 42: 68-73.
6. Selvaag E, Eriksen B, Thune P. Contact allergy to tea tree oil and cross-sensitisation to colophony. Contact Dermatitis 1994: 31: 124-125.
7. Selvaag E, Holm J-O, Thune P. Allergic contact dermatitis in an aromatherapist with multiple sensitizations to essential oils. Contact Dermatitis 1995: 33: 354-355.
8. Bhushan M, Beck M H. Allergic contact dermatitis from tea tree oil in a wart paint. Contact Dermatitis 1997: 36: 117-118.
9. Guin J D, Kincannon J. Medication-induced contact reactions. Clin Dermatol 1997: 15: 511-525.
10. Standards Association of Australia. Australian standard for essential oils - oil of Melaleuca, терпинен-4-ол type (AS 2782-1985). Sydney: Standards Association of Australia, 1985.
11. Brophy J J, Davies N W, Southwell I A, Stiff I A, Williams L R. Gas chromatographic quality control for oil of Mela-leuca терпинен-4-ол type (Australian tea tree). J Agric Food Chem 1989: 37: 1330,1335.
12. Southwell I A. Tea tree constituents. In: Southwell I, Lowe R (eds): Tea tree: the genus Melaleuca. Singapore: Har-wood Academic Publishers, 1999: 29-62.
13. Weiss E A. Essential oil crops. Oxford: CAB International, 1997: 302-319.
14. Lassak E V, McCarthy T M. Australian Medicinal Plants. Sydney, New South Wales: Methuen Australia, 1983.
15. Perry N B, Brennan N J, Van Klink J W, Harris W, Douglas M H, McGimpsey J A, Smallfield B M, Andersen R E. Essential oils from New Zealand manuka and kanuka: chemotaxonomy of Leptospermum. Phytochemistry 1997: 44: 1485-1494.
16. Apted J H. Contact dermatitis associated with the use of tea tree oil. (Letter) Australas J Dermatol 1991: 32: 177.
17. De Groot A C. Airborne allergic contact dermatitis from tea tree oil. Contact Dermatitis 1996: 35: 304-305.
18. Knight T E, Hausen B M. Melaleuca oil (tea tree oil) dermatitis. J Am Acad Dermatol 1994: 30: 423-427.
19. Southwell I A, Freeman S, Rubel D. Skin irritancy of tea tree oil. Journal of Essential Oil Research 1997: 9: 47-52.
20. Hausen B M, Reichling J, Harkenthal M. Degradation products of monoterpenes are the sensitizing agents in tea tree oil. Am J Contact Dermatitis 1999: 10: 68-77.
21. Harkenthal M, Hausen B M, Reichling J. 1,2,4-trihydroxy-menthane, a contact allergen from oxidized Australian tea tree oil. Pharmazie 2000: 55: 153-154.
22. Carson C F, Cookson B D, Farrelly H D, Riley T V Susceptibility of methicillin-resistant Staphylococcus aureus to the essential oil of Melaleuca alternifolia. J Antimicrob Chem-other 1995: 35: 421-424.
23. Hammer K A, Carson C F, Riley T V. Susceptibility of transient and commensal skin flora to the essential oil of Melaleuca alternifolia (tea tree oil). Am J Infect Control 1996: 24: 186-189.
24. Harkenthal M, Reichling J, Geiss H K, Saller R. Comparative study on the in vitro antibacterial activity of Australian tea tree oil, cajuput oil, niaouli oil, manuka oil, kanuka oil, and eucalyptus oil. Pharmazie 1999: 54: 460,463.
25. Jandourek A, Vaishampayan J K, Vazquez J A. Efficacy of melaleuca oral solution for the treatment of fluconazole refractory oral candidiasis in AIDS patients. AIDS 1998: 12: 1033-1037.
26. Caelli M, Porteous J, Carson CF, Heller R, Riley T V Tea tree oil as an alternative topical decolonization agent for methicillin-resistant Staphylococcus aureus. J Hosp Infect 2000: 46: 236-237.
Влияние органики, катионов и поверхностно-активных веществ на антимикробную активность масла Melaleuca alternifolia (чайное дерево) in vitro
K.A. Hammer 1 , C.F. Carson 1 и T.V. Riley 1,2
1 Отделение микробиологии, университет Западной Австралии
2 Отделение микробиологии и инфекционных болезней медицинского центра патологии и медицинских исследований Западной Австралии им. королевы Елизаветы II, Недлендс, Западная Австралия
k.a. hammer, c.f. carson and t.v. riley. 1999. Исследовалось влияние определенных органических веществ и условий на антимикробную активность масла Melaleuca alternifolia (чайное дерево). Разведением в бульоне и в агаре определялась минимальная ингибирующая и цидальная концентрация масла чайного дерева отдельно и в присутствии посторонних органических веществ. Активность исследовалась в отношении грамположительных и грамотрицательных бактерий, а также к Candida albicans. Оценена минимальная ингибиторная и минимальная цидальная концентрации, отличающиеся от контролей на два и более разведения, по отношению к одному или нескольким тестовым микроорганизмам в присутствии таких посторонних веществ, как Твин-20, Твин-80, порошок снятого молока и бычий сывороточный альбумин. Исследование не обнаружило отличий при выполнении анализов в анаэробных условиях, или в присутствии ионов кальция и магния. Влияние органики на антимикробную активность масла чайного дерева исследовалось тестом нейтрализации органического грунта. Исследуемые микроорганизмы подвергались воздействию летальных концентраций масла чайного дерева (начиная от 1,10 об.%) в присутствии сухих пекарских дрожжей 1,30% (мас./об.). После десятиминутного контакта определялась жизнеспособность микроорганизмов. При уровнях ≥ 1% органика ослабляла активность всех исследуемых концентраций масла чайного дерева по отношению к Staphylococcus aureus и C. albicans. Что касается Pseudomonas aeruginosa, то активность масла чайного дерева ослаблялась при содержании органики более 10%. В экспериментах с Escherichia coli органика ослабляла активность концентраций масла чайного дерева 1 и 2%, и не влияла на активность при концентрациях 4 и 8%. Сделан вывод о том, что органические и поверхностно-активные вещества ослабляют антимикробную активность масла чайного дерева, хотя это действие для различных микроорганизмов проявляется в разной степени.
ПРЕДИСЛОВИЕ
Эфирное масло, получаемое из произрастающего в дикой природе Австралии растения Melaleuca alternifolia , называют маслом чайного дерева. Это масло содержит более 100 компонентов, из которых большая часть это монотерпены, сесквитерпены и их спирты (Brophyс соавторами, 1989). Международный стандарт 4730 по маслу мелалеуки терпинен-4-ол типа (масло чайного дерева) приводит хроматографические профили, которые устанавливают максимальное и минимальное процентное содержание 14 компонентов масла (Международная организация стандартизации, 1996 г.). Это позволяет выполнять оценку качества промышленно выпускаемого масла чайного дерева.
Масло чайного дерева применяется местно для лечения различных кожных нарушений, в частности, угрей, опоясывающего лишая, реакций на укусы насекомых и ожоги (Altman1989), т.к. масло обладает антимикробными свойствами и известными противовоспалительными, проникающими и обезболивающими эффектами (Carsonи Riley1993). Первыми для медицинских целей растение M . alternifolia начали применять аборигены племени Бунджалунг в северной части Нового Южного Уэльса, где это растение произрастает в дикой природе (Carsonи Riley1993). Масло с переменным успехом сначала получило распространение в Австралии и сегодня входит в состав многочисленных косметических и фармацевтических продуктов, выпускаемых во всем мире (Carsonи Riley1993; Knightи Hausen1994).
Последние исследования масла чайного дерева были сфокусированы на изучении его бактерицидных (Hammerс соавторами, 1996), противогрибковых (Nenoffс соавторами, 1996) и, в меньшей степени, противовирусных свойств этого масла (Bishop1995). Намного меньше известно о механизме действия масла на микроорганизмы (Gustafsonс соавторами, 1998), о потенциальных эффектах других веществ и об условиях, способных влиять на антимикробную активность масла. Несмотря на отсутствие доказательств, получило широкое распространение мнение, что антимикробные свойства масла чайного дерева сохраняются или даже усиливаются в присутствии крови или гноя, которое впервые было высказано Humphery1930, Penfoldи Morrison1937. По этой причине было решено оценить различные факторы, способные влиять на эффекты масла, а также антимикробную активность масла чайного дерева к различным микроорганизмам.
МАТЕРИАЛЫ И МЕТОДЫ
Масло чайного дерева
Масло чайного дерева (МЧД) для исследований было любезно предоставлено компанией AustralianPlantationsPtyLtd, Вираллах/Wyrallah, штат Новый Южный Уэльс (НЮУ), Австралия. Партии 93/04 и 971 соответствовали требованиям стандарта ISO4730. Содержание определенных компонентов определялось газовой хроматографией и масс-спектрофотометрией в сельскохозяйственном институте WollongbarAgriculturalInstitute, Воллонгбар/Wollongbar, шт. НЮУ, Австралия. По результатам исследования партия 93/04 содержала 37,1% терпинен-4-ола и 3,2% 1,8-цинеола. Партия 971 содержала 41,5% терпинен-4-ола, 21,2% g-терпинена, 10,2% a-терпинена, 3,5% терпинолена, 2,9% a-терпинеола, 2,5% a-пинена, 2,1% 1,8-цинеола и 1,5% п-цимена.
Тестовые микроорганизмы и приготовление инокулята
Микроорганизмы для исследований были получены из коллекций культур отделения микробиологии университета Западной Австралии и из отделения микробиологии и инфекционных болезней Западно-австралийского центра патологии и медицинских исследований. Использовались следующие изоляты: Acinetobacter baumanii NCTC7844 , Aeromonas veronii biogroup sobria ATCC9071 ( Aer . sobria ), Candida albicans ATCC10231 , Enterococcus faecalis NCTC8213 , Escherichia coli NCTC10418 , Klebsiella pneumoniae NCTC11228 , Pseudomonas aeruginosa NCTC10662 , Salmonella enterica subsp . enterica serotype typhimurium NCTC74 ( Salm . typhimurium ), Ser - ratia marcescens NCTC1377 and Staphylococcus aureus NCTC6571. Все изоляты поддерживались на кровяном агаре. Ночные культуры готовились инокуляцией 2-3 колоний на 2-3 мл бульона Мюллера-Хинтона (БМХ) с последующей инкубации на протяжении ночи при 35 °Cс периодическим встряхиванием. Для анализа разведений в агаре выполнялось разведение ночных культур в физрастворе примерно до 10 6 или 10 7 колониеобразующих единиц (КОЕ) на мл -1 для соответственно C. albicansи бактерий, что соответствовало примерно 10 3 или 10 4 КОЕ/мл инокуляционного пятна. Для анализа разведений в бульоне выполнялось разведение культур до конечной концентрации инокулята примерно 5 x10 5 КОЕ/мл с подтверждением подсчетом количества жизнеспособных микроорганизмов.
Определение МИК и МЦК
Анализы разведений в агаре выполнялись добавлением МЧД (партия 93/04) в двойных разведениях с 2% до 0,03% (об./об.) на агаре Мюллера-Хинтона (АМХ) без или в присутствии исследуемого вещества. Для улучшения растворимости масла все разведения содержали полиоксиэтилен (20) сорбитан монолаурат (Твин-20) в конечной концентрации 0,5% (об./об.). В качестве контроля использовался кровяной агар или агар с 0,5% Твин-20, содержащий в зависимости от основного испытания или не содержащий соответствующее исследуемое вещество. Чашки сушились 30 минут и затем при помощи многоточечного репликатора (MastLaboratoriesLtd, Ливерпуль, Великобритания) выполнялась инокуляция четырех инокуляционных пятен каждой изоляты. Чашки инкубировались при 35 °C, после чего определялась минимальная ингибирующая концентрация (МИК) для бактерий через 24 часа и для C. Albicansчерез 48 часов. В данном исследовании применялось следующее определение МИК: наименьшая концентрация масла чайного дерева, предупреждающая видимый рост одной или двух колоний. Анализы разведений в агаре в присутствии посторонних веществ выполнялись по одному разу.
Анализы микроразведений в бульоне выполнялись добавлением МЧД (партия 93/04) к БМХ серией двойных разведений с 5% до 0,03% в присутствии каждого исследуемого постороннего вещества и без них. Для улучшения растворимости масла все разведения содержали Твин-20 в конечной концентрации 0,001% (об./об.). Применялись два контроля роста. Один – это БМХ с 0,001% Твин-80 и второй – БМХ с 0,001% Твин-80, плюс соответствующее постороннее исследуемое вещество. Микротитрационные планшеты инокулировались микроорганизмами и инкубировались при температуре 35 °C. После 24 часов в случае исследования бактерий или после 48 часов для C. albicansиз каждой лунки планшета бралось по 10 мл субкультур и выполнялась пятненная инокуляция на АМХ. После инкубации субкультур определялись МИК и МЦК. В данном исследовании МИК определялась, как наименьшая концентрация масла чайного дерева, вызывающая сохранение или уменьшение инокулята, а МЦК – наименьшая концентрация масла, при которой наступает гибель 99,9% инокулята. Анализы разведений в бульоне выполнялись по два раза. В случае различия результатов, тесты повторялись и брались наиболее вероятные значения.
Эффект анаэробных условий
Анаэробные условия создавались в анаэробной камере (DonWhitleyScientificLtd, Шипли, Великобритания) с атмосферой 10% H 2 , 10% CO 2 и 80% N 2 . При приведении анализов разведений в агаре (партия 93/04) выполнялась инкубация в аэробных условиях 48 часов и затем определялись значения МИК. Эти опыты выполнялись по три раза, и бралось наиболее вероятное значение. При анализах разведений в бульоне (партия 971) микротитрационные планшеты помещались в анаэробную камеру не менее чем на 2 часа, и затем выполнялась инокуляция. Сразу после инокуляция планшеты возвращались в анаэробную камеру и субкультуры выращивались на протяжении 24 часов в случае бактерий или 48 часов для C. albicans.
Влияние катионов
Готовился бульон Мюллера-Хинтона в жесткой воде, содержащей 0,304 г/л CaCl 2 и 0,065 г/л MgCl 2 (Graham1978). Кроме того, в БМХ готовились растворы, содержащие 50 ммоль/л Ca 2+ и (или) Mg 2+ .
Влияние органических веществ
Исследовались следующие органические вещества (в одной или нескольких концентрациях): овечья кровь (об./об.), лошадиная сыворотка (об./об.), бычий сывороточный альбумин (БСА) (мас./об.), сухие пекарсике дрожжи (мас./об.) и порошковое снятое молоко (мас./об.) (UnipathLtd, Басингсток, Великобритания). Бычий сывороточный альбумин растворяли в дистиллированной воде и после стерилизации фильтрованием добавлялся в стерильную среду. Пекарские дрожжи и порошковое снятое молоко растворяли в БМХ или АМХ и затем стерилизовали в автоклаве.
Влияние поверхностно-активных веществ
После стерилизации среды в автоклаве в асептических условиях (расчет об./об.) добавлялись следующие посторонние вещества: Твин-20, Твин-80 и алкилдиметилетаин (АДБ) (EmpigenBB) (Albrightи Wilson, WetherillPark, НЮУ, Австралия). В БМХ растворяли монододецилсульфат натрия (МСН) (мас./об.) и затем выполняли автоклавирование.
Метод Уайтмора-Минера
Предварительно проводились эксперименты по определению количества масла чайного дерева, полностью убивающего весь инокулят согласно параметрам методики Уайтмора и Минера (Whitmoreи Miner, 1976). Микроорганизмы инокулировались в растворы масла чайного дерева (партия 971) следующих концентраций (% об./об.): 0,25, 0,5, 1, 2, 4, 6, 8 и 10. Инкубация, субкультивирование и регистрация роста выполнялись согласно приведенному ниже описанию. Эта процедура повторялась в другие дни до тех пор, пока для каждого микроорганизма не подбиралась наиболее вероятная минимальная летальная концентрация (МЛК). После этого выполнялись тесты нейтрализации органического грунта при значениях концентрации МЧД больше или равно МЛК соответствующего микроорганизма.
Сухие пекарские дрожжи измельчались до однородной консистенции по описанию Уайтмора и Минера (1976) и в стеклянных сосудах Маккартни взвешивались следующие количества дрожжей: 3, 2, 1, 0,5 и 0,1 г. После автоклавирования образовавшиеся комки разбивались вихревой мешалкой. В стерильной дистиллированной воде готовились растворы МЧД с конечной концентрацией Твин-80 0,001%. Через точно отмеренные интервалы времени 10 мл раствора МЧД добавлялось к каждой порции сухих дрожжей, смесь перемешивалась вихревой мешалкой и 2 часа инкубировалась при 25 °Cв водяной бане. Каждая серия включала контрольный раствор МЧД без дрожжей. Через 2 часа по 100 мкл суспензии с примерно 10 8 КОЕ/мл Staph . aureus , E . coli или Ps . aeruginosa , или 10 7 КОЕ/мл при исследовании C . albicans с заданной периодичностью инокулировались на серии смеси дрожжи/МЧД. Содержимое всех пробирок непосредственно до и после инокуляции перемешивалось вихревой мешалкой. Пробирки возвращались в водяную баню, и через 10 минут бралось по 1 мл смеси дрожжи/МЧД/микроорганизм и добавлялось в 9 мл питательного бульона №2 (ПБ №2). Из этой начальной субсультуры в ПБ №2 готовилось два дополнительных разведения одного из 10 последовательных разведений. Пробирки с субкультурами инкубировались 48 часов при 35°C. После этого отмечалась мутность бульона и на питательный агар (ПА) выполнялась пятненная инокуляция 25 мкл аликвотных проб из каждой пробирки. После инкубации чашек ПА отмечалось наличие или отсутствие роста. Рост любой субкультуры фиксировался как общий положительный результат. Тесты с каждым исследуемым микроорганизмом выполнялись не менее двух раз в разные дни. Бралось наиболее вероятное значение положительного или отрицательного роста каждой смеси дрожжи/МЧД/микроорганизм. Число нейтрализации рассчитывалось умножением на 10 максимального количества дрожжей, не показавших роста во всех пробирках с субкультурами.
РЕЗУЛЬТАТЫ
Влияние анаэробных условий
Как видно из таблицы 1, значения МИК и МЦК полученные в аэробных и анаэробных условиях отличались не более, чем на одно разведение.
Анализы разведений в бульоне и в агаре
Результаты анализов разведений в бульоне и в агаре в присутствии посторонних исследуемых веществ показаны в таблице 2. Анализы с добавлением Твин-80 для A . baumanii , Aer . sobria , Ent . faecalis , E . coli и Staph . Aureus показали МИК на два последовательные разведения больше контроля. Остальные значения МИК были равны или отличались на одно разведение. Результаты анализов микроразведений в бульоне в присутствии посторонних веществ показаны в таблице 3. Значения МИК и МЦК в присутствии катионов были равны или отличались на одно разведение. Для Staph . aureus МЦК в присутствии БСА и снятого молока были больше на два разведения. Для C . albicans МИК в присутствии БСА были больше на два разведения. Для C . albicans МИК и МЦК в присутствии 10% Твин-20 были больше также на два разведения. Все значения МИК и МЦК в присутствии 5% и 10% Твин-80 были больше на два разведения, за исключением МИК и МЦК для E . coli и МЦК для C . albicans в присутствии 5% Твин-80. Поверхностно-активные вещества МСН и АДБ препятствовали росту определенных тестовых микроорганизмов.
Метод Уайтмора-Минера
Результаты экспериментов по Уайтмору-Минеру показаны в таблице 4. Были получены следующие значения МЛК: для E . coli 0,5%, Staph . aureus 4,0% , Ps . aeruginosa 1,0% и для C . albicans 2,0%. Присутствие дрожжей ослабляло летальные эффекты двух и более концентраций МЧД по отношению к тестовым микроорганизмам. Так, летальные для Staph . aureus и C . albicans концентрации МЧД в присутствии 0,1 г дрожжей не убивали эти микроорганизмы.
Таблица 1. Значения МИК и МЦК (% об./об.) масла чайного дерева для различных микроорганизмов в аэробных и анаэробных условиях по результатам анализов разведений в агаре и бульоне.
|
Микроорганизм |
Разведения в агаре |
Разведения в бульоне |
||||
|
Аэробные условия |
Анаэробные условия |
Аэробные условия |
Анаэробные условия |
Аэробные условия |
Анаэробные условия |
|
|
МИК |
МИК |
МИК |
МЦК |
МИК |
МЦК |
|
|
Aeromonas sobria |
0,25 |
0,25 |
0,25 |
0,25 |
0,12 |
0,25 |
|
Candida albicans |
0,5 |
0,25 |
0,25 |
0,5 |
0,25 |
0,5 |
|
Enterococcus faecalis |
1,0 |
1,0 |
4,0 |
>4,0 |
2,0 |
>4,0 |
|
Escherichia coli |
0,25 |
0,25 |
0,12 |
0,12 |
0,25 |
0,25 |
|
Klebsiella pneumoniae |
0,5 |
0,5 |
0,25 |
0,25 |
0,5 |
0,5 |
|
Salmonella typhimurium |
0,5 |
0,5 |
0,25 |
0,25 |
0,5 |
0,5 |
|
Serratia marcescens |
0,5 |
0,5 |
0,25 |
0,25 |
0,5 |
0,5 |
|
Staphylococcus aureus |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
1,0 |
Таблица 2. Значения МИК (% об./об.) масла чайного дерева, полученные методом разведений в агаре отдельно и в присутствии 5% посторонних веществ с потенциальным влиянием на МЧД.
|
Микроорганизм |
Отдельно МЧД |
Твин-20 |
Твин-80 |
Овечья кровь |
БСА |
Пекарские дрожжи |
|
Acinetobacter baumanii |
0,25 |
0,5 |
1,0 |
н.о.* |
0,5 |
0,5 |
|
Aeromonas sobria |
0,25 |
0,5 |
1,0 |
н.о. |
0,5 |
0,5 |
|
Caн.о.ida albicans |
0,5 |
1,0 |
0,5 |
0,5 |
0,5 |
0,5 |
|
Enterococcus faecalis |
1,0 |
0,5 |
>2,0 |
2,0 |
1,0 |
2,0 |
|
Escherichia coli |
0,25 |
1,0 |
1,0 |
0,25 |
0,5 |
0,5 |
|
Klebsiella pneumoniae |
0,5 |
1,0 |
1,0 |
0,5 |
0,5 |
1,0 |
|
Pseudomonas aeruginosa |
>2,0 |
>2,0 |
>2,0 |
н.о. |
>2,0 |
>2,0 |
|
Salmonella typhimurium |
0,5 |
1,0 |
1,0 |
0,5 |
0,5 |
0,5 |
|
Serratia marcescens |
0,5 |
1,0 |
1,0 |
0,5 |
0,5 |
1,0 |
|
Staphylococcus aureus |
0,5 |
0,5 |
2,0 |
0,5 |
0,5 |
1,0 |
* н.о. – не определено.
При концентрации МЧД меньше 4%, дрожжи ослабляли летальные эффекты МЧД на E . coli , однако при концентрации больше 4% наличие дрожжей не оказывало ослабляющего действия на летальность МЧД. Что касается Ps . aeruginosa , то концентрации МЧД 2% и 4% в присутствии ≥ 0,1 г дрожжей не обеспечивали гибели инокулята. Тесты с C . albicans при концентрациях МЧД 8% и 10% показали невоспроизводимые результаты, поэтому выбрать наиболее вероятное значение не удалось. Наблюдался рост Staphylococcus aureus в пробирках с субкультурой в присутствии количеств МЧД более МИК (0,25%) и MBC(0,5%), но лишь в тех тестах, в которых количество дрожжей составляло 1, 2 или 3 г (данные не показаны). Во всех субкультурах, содержащих МЧД в количествах выше соответствующих значений МИК или МЦК рост Escherichia coli и C . albicans не наблюдался. Все микроорганизмы в одном или нескольких опытах показали рост при последовательном разведении 10 -3 , а при разведениях 10 -1 и 10 -2 рост отсутствовал. Добавление последовательного разведения 10 -4 не улучшило восстановления микроорганизмов, т.к. если рост происходил при разведении 10 -3 , то он был неизбежен и при разведении 10 -4 .
ОБСУЖДЕНИЕ
В представленном сниманию читателя исследовании изучалось влияние различных посторонних веществ и условий на антимикробную активность масла чайного дерева. Эксперименты показали, что присутствие катионов или анаэробные условия не оказывают негативного влияния, но присутствие поверхностно активных веществ и органического материала ухудшает эффективность МЧД.
Влияние катионов на активность антимикробных соединений может объясняться образованием хелатов между ионами и антимикробным веществом, а также защитой внешних мембран бактерий от потери катионов под влиянием антимикробного агента (Marshallи Piddock1994). Предполагалось, что анаэробные условия могут усилить антимикробную активность МЧД за счет химической перестройки компонентов масла в более активные антимикробные соединения, или же за счет изменения микробного метаболизма, затрагивающего поглощение и (или) активацию МЧД (Parkс соавторами 1992). Однако обнаруженное в данном исследовании отсутствие влияния этих условий на антимикробную активность заставляет предположить отличающееся от указанных механизмов действие МЧД.
Известна способность поверхностно-активных веществ ослаблять активность многих антимикробных веществ, и они давно применяются в качестве стандартных нейтрализаторов фенолов, крезолов и четвертичных аммониевых соединений (Bloomfield1991; Russellс соавторами, 1992). ПАВ также ослабляют активность эфирных масел (Remmalс соавторами 1993), включая и масло чайного дерева (Carsonи Riley1996). Предполагается, что ПАВ влияют на антимикробную активность растворяющих молекул антимикробного вещества заключая их внутри мицелл ПАВ, в результате чего ограничиваются возможности антимикробного вещества воздействовать на микроорганизмы (Allwoodи Shaw1987; Russellс соавторами, 1992). Также было продемонстрировано, что в достаточно высоких концентрациях некоторые ПАВ сами способны оказывать летальное действие на микроорганизмы (Russellи Chopra1990).
Таблица 3. Значения МИК и МЦК (% об./об.) масла чайного дерева, полученные методом микроразведений в бульоне отдельно и в присутствии посторонних веществ с потенциальным влиянием на МЧД.
|
Тест |
Концен-трация |
Staphylococcus aureus |
Escherichia coli |
Candida albicans |
|||
|
МИК |
МЦК |
МИК |
МЦК |
МИК |
МЦК |
||
|
Отдельно МЧД |
0,25 |
0,5 |
0,25 |
0,25 |
0,25 |
0,5 |
|
|
Жесткая вода |
0,25 |
0,5 |
0,25 |
0,25 |
0,25 |
0,5 |
|
|
Mg 2+ |
50 ммоль/л |
0,25 |
0,5 |
0,12 |
0,12 |
0,12 |
0,25 |
|
Ca 2+ |
50 ммоль/л |
0,25 |
1,0 |
0,25 |
0,25 |
0,25 |
0,5 |
|
Mg 2+ и Ca2+ |
50 ммоль/л |
0,25 |
0,5 |
0,25 |
0,25 |
0,12 |
0,25 |
|
БСА |
10% |
0,5 |
2,0 |
0,5 |
0,5 |
1,0 |
1,0 |
|
Снятое молоко |
10% |
0,5 |
2,0 |
0,25 |
0,5 |
0,25 |
0,5 |
|
Пекарские дрожжи |
5% |
0,25 |
0,25 |
0,5 |
0,5 |
0,25 |
1,0 |
|
Лошадиная сыворотка |
5% |
0,12 |
0,25 |
0,12 |
0,12 |
0,12 |
0,25 |
|
10% |
0,12 |
0,25 |
0,12 |
0,12 |
0,25 |
0,5 |
|
|
Твин-20 |
5% |
н.о. |
н.о. |
0,5 |
0,5 |
0,5 |
1,0 |
|
10% |
н.о. |
н.о. |
н.о. |
н.о. |
1,0 |
2,0 |
|
|
Твин-80 |
5% |
2,0 |
2,0 |
0,5 |
0,5 |
1,0 |
1,0 |
|
10% |
2,0 |
>4,0 |
2,0 |
2,0 |
2,0 |
4,0 |
|
|
МСН |
1% |
О.р. |
О.р. |
0,25 |
0,25 |
О.р. |
О.р. |
|
5% |
О.р. |
О.р. |
0,25 |
0,25 |
О.р. |
О.р. |
|
|
10% |
О.р. |
О.р. |
0,25 |
0,25 |
О.р. |
О.р. |
|
|
АДБ |
1% |
О.р. |
О.р. |
0,25 |
0,25 |
О.р. |
О.р. |
О.Р. – отсутствие роста.
н.о. – не определено.
Результаты анализов микроразведений в бульоне и экспериментов по Уайтмору-Минеру показали, что органика ослабляет антимикробную активность МЧД. Одним из объяснений этого явления может быть взаимодействие между органическим веществом и активными участками антимикробного вещества, сопровождающееся снижением концентрации активного антимикробного вещества (Gormanи Scott1980). Если имеет место именно такое взаимодействие, то должно было происходить одинаковое ослабление активности по отношению ко всем исследуемым микроорганизмам. Однако анализ разведений в бульоне показал, что ни одно исследуемое органического вещество отдельно не ослабляло активности МЧД к трем тестовым микроорганизмам. Это заставляет предположить, что если и имеет место именно этот механизм ослабления антимикробной активности, то он проявляется согласованно с другими специфическими для микроорганизмов факторами. На такие специфические для микроорганизмов факторы также указывают отличия результатов разных микроорганизмов, наблюдаемые в экспериментах по Уайтмору-Минеру. Специфичность по отношению к микроорганизмам можно объяснить гидростатическим сцеплением органического вещества с микробной клеткой, которое защищает клетку от воздействия антимикробного агента (Gormanи Scott1980; Gorbachс соавторами, 1992; Russellс соавторами, 1992). Кроме того, возможно, упоминаемое выше взаимодействие между органическим и антимикробным веществами приводит к образованию форм, которые хуже поглощаются некоторыми микроорганизмами (Bean1967).
Таблица 4. Рост микроорганизмов в субкультурах после экспозиции масла чайного дерева (% об./об.) в присутствии разных количеств дрожжей.
|
Микроорганизмы |
Масло чайного дерева (%) |
Содержание дрожжей (г) в 10 мл раствора масла чайного дерева. |
Число нейтрализации |
|||||
|
0 |
0,1 |
0,5 |
1,0 |
2,0 |
3,0 |
|||
|
Cadida albicans |
2,0 |
+ |
+ |
+ |
+ |
+ |
||
|
4,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
|
6,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
|
Escherichia coli |
1,0 |
– |
– |
+ |
+ |
+ |
+ |
1 |
|
2,0 |
– |
– |
– |
– |
+ |
+ |
10 |
|
|
4,0 |
– |
– |
– |
– |
– |
– |
>30 |
|
|
8,0 |
– |
– |
– |
– |
– |
– |
>30 |
|
|
Pseudomonas aeruginosa |
2,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
4,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
|
6,0 |
– |
- |
+ |
+ |
+ |
+ |
1 |
|
|
8,0 |
– |
- |
- |
+ |
+ |
+ |
5 |
|
|
10,0 |
– |
- |
+ |
+ |
+ |
+ |
1 |
|
|
Staphylococcus aureus |
4,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
6,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
|
8,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
|
10,0 |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
–: отсутствие роста во всех разведениях субкультур;
+: рост в одной или несколькихразведениях субкультур.
Это исследование показало, что лишь органика определенных типов влияет на антимикробную активность МЧД. Ранее подобный эффект уже наблюдался, и предполагалось, что эти различия могут быть обусловлены отличиями относительной растворимости и содержания белка в органике разных типов (Gelinasи Goulet1983).
Анализы разведений в агаре и бульоне показали несовпадающие вещества, влияющие на антимикробную активность МЧД. Это несоответствие может объясняться различиями анализов по росту микроорганизмов и экспозиции антимикробным агентом (Riosс соавторами, 1988; Hiliс соавторами, 1997). Присутствие дрожжей хотя достоверно и не влияло на результаты анализов разведений в агаре и в бульоне, эксперименты по Уайтмору-Минеру показали явное влияние дрожжей на антимикробную активность. Возможно, это следствие существенных методологических отличий, например, продолжительности экспозиции МЧД на микроорганизмы и температуры проведения анализов.
Методику Уайтмора-Минера можно усовершенствовать выполнением подсчета жизнеспособных микроорганизмов вместо сообщения результата как положительный или отрицательный рост. Это позволит повысить воспроизводимость, поскольку результаты «положительный рост»/«отрицательный рост» сильно искажаются ошибками выборки (Coates1988; Bloomfield1991; Minerс соавторами, 1997). Подсчет числа жизнеспособных микроорганизмов позволит рассчитывать логарифмический показатель снижения численности – параметр, широко применяемый для измерения антимикробной активности веществ (Coates1988). Кроме того, методику можно дополнить несколькими (вместо одного) моментами времени, что позволит исследовать изменения антимикробной активности как функцию от времени.
Все влияющие на активность взаимодействия позволяют лучше понять механизм действия МЧД, о котором достаточно мало известно (Gustafsonс соавторами 1998). Среди интересных гипотез можно выделить следующие: механизмы антимикробного действия разные для разных типов микроорганизмов; или, поскольку МЧД содержит более 100 компонентов, то они могут действовать по-разному, и некоторые из них могут синергически воздействовать на микробные клетки. Проведенные ранее исследования показали разную степень активности определенных компонентов МЧД по отношению к микроорганизмам (Carsonи Riley1995). Поэтому могут оказаться полезными исследования очищенных компонентов. Другим интересным направлением является исследование каких-то других факторов или условий, способных влиять на антимикробную активность МЧД, например, рН и температуры. Также будет полезной идентификация веществ, нейтрализующих активность МЧД, поскольку во многих исследованиях антимикробной активности применяется один или несколько нейтрализаторов для остановки текущих эффектов антимикробных агентов и микробных клеток (Russellс соавторами 1992).
Также пока остаются малоизученными взаимодействия между местно применяемым МЧД и органическим дебрисом кожи, слизистых оболочек или ран. Вместе с тем, эти органические вещества могут влиять на клиническую эффективность МЧД или получаемых на его основе препаратов. На клиническую эффективность также может повлиять состав фармацевтического средства с МЧД. Не исключено, что кроме поверхностно-активных веществ другие наполнители фармацевтической формулы также способны ослаблять активность антимикробных компонентов (Allwoodи Shaw1987), в том числе и МЧД.
Итак, данная работа показала, что поверхностно-активные вещества ослабляют антимикробную активностью МЧД, вероятнее всего, за счет мицеллярной солюбилизации. Органика также оказывала подобное влияние на активность, скорее всего при помощи не одного, а нескольких механизмов, в том числе и реакций между органикой и МЧД в сочетании со специфическими для данного микроорганизма факторами. Подобные взаимодействия способны влиять на клиническую эффективность МЧД и получаемых на его основе препаратов, поэтому требуют дальнейшего изучения.
БЛАГОДАРНОСТЬ
Эта работа была выполнена при поддержке компании Australian Bodycare Corporation Pty Ltd, Currumbin, шт. Новый Южный Уэльс, Австралия и, частично, на средства гранта от Rural Industries Research и Development Corporation (UWA-24 A).
СПИСОК ЛИТЕРАТУРЫ
Allwood, M.C. and Shaw, R.J.S. (1987) Preservation of mixtures, suspensions and syrups. In Preservatives in the Food, Pharmaceutical and Environmental Industries ed. Board, R.G., Allwood, M.C. and Banks J.G. pp. 197-210. Oxford, UK: Blackwell Scientific Publications.
Altman, P.M. (1989) Australian tea tree oil - a natural antiseptic. Australian Journal of Biotechnology 3, 247-248.
Bean, H.S. (1967) Types and characteristics of disinfectants. Journal of Applied Bacteriology 30, 6-16.
Bishop, C.D. (1995) Antiviral activity of the essential oil of Mel-aleuca alternifolia (Maiden and Betche) Cheel (tea tree) against tobacco mosaic virus. Journal of Essential Oil Research 7, 641-644.
Bloomfield, S.F. (1991) Methods for assessing antimicrobial activity. In Mechanisms ofAction ofChemical Biocides, Their Study and Exploitation ed. Denyer, S.P. and Hugo, W.B. pp. 1-22. Oxford, UK: Blackwell Scientific Publications.
Brophy,J.J., Davies, N.W., Southwell, I.A., Stiff, I.A. and Williams, L.R. (1989) Gas chromatographic quality control for oil of Mel-aleuca terpinen-4-ol type (Australian tea tree). Journal ofAgri-cultural and Food Chemistry 37, 1330-1335.
Carson, C.F. and Riley, T.V. (1993) Antimicrobial activity of the essential oil of Melaleuca alternifolia. Letters in Applied Microbiology 16, 49-55.
Carson, C.F. and Riley, T.V. (1995) Antimicrobial activity of the major components of the essential oil of Melaleuca alternifolia. Journal of Applied Bacteriology 78, 264-269.
Carson, C.F. and Riley, T.V. (1996) Working with and against tea tree oil - issues of synergy and antagonism. Abstract 8. In Program and Abstracts of the 19th International Federation of the Societies ofCosmetic Chemists Congress. Sydney, Australia: International Federation of the Societies of Cosmetic Chemists.
Coates, D. (1988) Comparison of sodium hypochlorite and sodium dichloroisocyanurate disinfectants: neutralization by serum. Journal of Hospital Infection 11, 60-67.
Gelinas, P. and Goulet, J. (1983) Neutralisation of the activity of eight disinfectants by organic matter. Journal ofApplied Bacteriology 54, 243-247.
Gorbach, S.L., Bartlett, J.G. and Blacklow, N.R. (1992) Infectious Diseases. Philadelphia, USA: W.B. Saunders, Company.
Gorman, S.P. and Scott, E.M. (1980) A review. Antimicrobial activity, uses and mechanism of action of glutaraldehyde. Journal ofApplied Bacteriology 48, 161-190.
Graham, B.M. (1978) The development of Australian legislation for disinfectants. Australian Journal ofHospital Pharmacy8, 149-155.
Gustafson, J.E., Liew, Y.C., Chew, S. et al. (1998) Effects of tea tree oil on Escherichia coli. Letters in Applied Microbiology 26, 194198.
Hammer, K.A., Carson, C.F. and Riley, T.V. (1996) Susceptibility of transient and commensal skin flora to the essential oil of Mel-aleuca alternifolia (tea tree oil). American Journal ofInfection Control 24, 186-189.
Hili, P., Evans, C.S. and Veness, R.G. (1997) Antimicrobial action of essential oils: the effect of dimethylsulfoxide on the activity of cinnamon oil. Letters in Applied Microbiology 24, 269-275.
Humphery, E.M. (1930) A new Australian germicide. Medical Journal ofAustralia 1, 417-418.
International Organisation for Standardization (1996) ISO 4730 Oil of Melaleuca, terpinen-4-ol type (tea tree oil). Switzerland: International Organisation for Standardization.
Knight, T.E. and Hausen, B.M. (1994) Melaleuca oil (tea tree oil) dermatitis. Journal ofthe American Academy ofDermatology 30, 423-427.
Marshall, A.J.H. and Piddock, L.J.V. (1994) Interaction of divalent cations, quinolones and bacteria. Journal ofAntimicrobial Chemotherapy34, 465-483.
Miner, N., Armstrong, M., Carr, C.D., Maida, B. and Schlotfeld,L. (1997) Modified quantitative Association of Official Analytical Chemists Sporicidal test for liquid chemical germicides. Applied and Environmental Microbiology63, 3304-3307.
Nenoff, P., Haustein, U.-F. and Brandt, W. (1996) Antifungal activity of the essential oil of Melaleuca alternifolia (tea tree oil) against pathogenic fungi in vitro. Skin Pharmacology 9, 388-394.
Park, M.K., Myers, R.A.M. and Marzella, L. (1992) Oxygen tensions and infections: modulation of microbial growth, activity of antimicrobial agents, and immunologic responses. Clinical Infectious Diseases 14, 720-740.
Penfold, A.R. and Morrison, F.R. (1937) Some notes on the essential oil of Melaleuca alternifolia. Australian Journal ofPharmacy 18, 274-275.
Remmal, A., Bouchikhi, T., Tantaoui-Elaraki, A. and Ettayebi, M. (1993) Inhibition of antibacterial activity of essential oils by Tween 80 and ethanol in liquid medium. Journal de Pharmacie deBelgique 48, 352-356.
Rios, J.L., Recio, M.C. and Villar, A. (1988) Screening methodsfor natural products with antimicrobial activity: a review of theliterature. Journal of Ethnopharmacology 23, 127-149.
Russell, A.D. and Chopra, I. (1990) Understanding AntibacterialAction and Resistance. West Sussex, UK: Ellis Horwood Ltd.
Russell, A.D., Hugo, W.B. and Ayliffe, G.A.J. (1992) Principles andPractice ofDisinfection, Preservation and Sterilisation, 2nd edn.Oxford, UK: Blackwell Scientific Publications.
Whitmore, E.J. and Miner, N.A. (1976) Analysis and optimizationof a quantitative organic soil neutralisation test for disinfectants.Journal of the Association of Official Analytical Chemists 59, 1344-1351.